«Угроза для населения нашей страны»: какие претензии эксперты предъявляют к российской вакцине от коронавируса
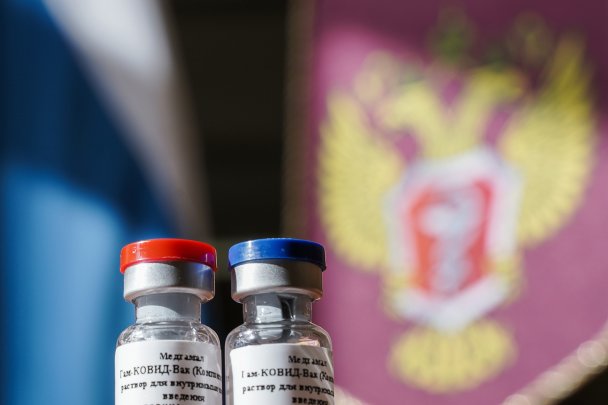
Во вторник, 11 августа, Владимир Путин на совещании с членами правительства объявил, что в России зарегистрирована первая в мире вакцина от коронавируса. Это препарат «Гам-Ковид-Вак», разработанный Национальным исследовательским центром имени Гамалеи. По словам Путина, вакцина «прошла все необходимые проверки». Одной из первых вакцину от COVID-19 еще до регистрации испытала на себе дочь Путина, рассказал президент: после прививок у нее поднималась температура, но сейчас она чувствует себя хорошо.
«С момента регистрации вакцины начинается третья фаза испытаний вакцины, — объяснил глава Российского фонда прямых инвестиций (РФПИ) Кирилл Дмитриев на брифинге во вторник. — Мы ожидаем, что десятки тысяч добровольцев будут привиты в течение месяца. С октября препарат начнут использовать для массовой вакцинации в России, опять-таки — на добровольной основе». В гражданский оборот вакцина поступит с 1 января.
При разработке вакцины Центр имени Гамалеи допустил ряд нарушений, вакцина получила регистрацию после клинического исследования менее чем на 100 человеках (тогда как на Западе тестирование ведется с привлечением тысяч человек), а сам препарат несет угрозу для населения, уверена исполнительный директор Ассоциации организаций по клиническим исследованиям (АОКИ) Светлана Завидова. В понедельник АОКИ, которая объединяет 25 зарубежных фармкомпаний, обратилась в Минздрав с просьбой отложить вопрос регистрации вакцины «Гам-Ковид-Вак» до того, как она пройдет все стадии клинической разработки. На это Дмитриев возразил, что Россия рассматривает заявление ассоциации как часть конкурентной борьбы, ведь в ассоциацию входит ряд крупных иностранных фармкомпаний, в том числе и разработчики собственной вакцины (среди них Pfizer, AstraZeneca). Forbes поговорил со Светланой Завидовой о том, что, по мнению АОКИ, не так с российской вакциной.
Почему АОКИ обратилась в Минздрав? Это не первое наше обращение. Индустрия клинических исследований жесткая в плане регулирования. В период пандемии мы столкнулись с тем, что начались массовые нарушения. В первую очередь со стороны отдельных отечественных разработчиков, в том числе тех, которые получили серьезную административную поддержку. На рынок выпускаются препараты либо выдается разрешение с какими-то нарушениями — в попытке ускорить процесс, найти панацею.
Разработка вакцины Центра имени Гамалеи сопровождается уже не первым скандалом. Начали разработчики с того, что проверили ее на себе, еще до того, как было получено разрешение на проведение исследования в Минздраве. Это обязательное требование всех известных нам законов. И в других странах до того, как начать давать препарат человеку, нужно сначала получить разрешение государственного органа. Потом эту разработку очень активно пиарили — в том числе чиновники совсем разных ведомств, включая Минобороны.
При этом ни одной научной публикации в отношении первой и второй фазы исследований (этой вакцины. — Forbes) мы не увидели. Идет пиар, но при этом отсутствует какая-либо внятная информация непосредственно о разработке. И назывались даты регистрации вакцины (что послужило для нас спусковым крючком). Замминистра здравоохранения в прошлую пятницу заявил, что 12 августа будет проведена регистрация вакцины, хотя сейчас проходит экспертиза. Обещания зарегистрировать сопровождали разработку постоянно.
Никто заранее, на этапе проверки, не может обещать, что продукт выйдет на рынок. Исследование лекарств, разработка лекарств — это высокорискованное дело. Считается, что из 5 продуктов, которые вышли на стадию клинических исследований, только один доходит до регистрации. А у нас только после первой-второй фазы обещают, что до какого-то числа будет регистрация. Если это озвучивает представитель здравоохранения, это означает, что где-то, в каких-то кабинетах, не дожидаясь экспертного решения, определили, что вакцина будет выпущена.
Зачем тогда вообще исследование? Мы можем без исследования выпускать любой продукт. К чему эти игры, получение доказательств, если у нас решение о регистрации уже принято задним числом? Мы посчитали, что нужно выступить, потому что такой подход серьезным образом противоречит международному. И в первую очередь он несет угрозу для населения нашей страны. Потому что с помпой выпустив продукт на рынок, мы рискуем тем, что участниками уже массового, неконтролируемого исследования будет все население.
Насколько критичны возможные нарушения? Изначально, когда они (сотрудники Центра имени Гамалеи. —
Forbes) попробовали на себе вакцину, это было нарушение закона об обращении лекарственных средств — в части проведения исследования без получения разрешения Министерства здравоохранения.
Потом, когда они привлекли к участию в исследовании военных — это скорее вопрос к совету по этике при Минздраве. Это исследование было разрешено, формально российское законодательство не нарушается, но нарушаются этические принципы проведения клинических исследований, в частности Хельсинкская декларация. Есть уязвимые группы пациентов — сотрудники фармацевтических компаний, военнослужащие, лица, находящиеся в заключении, несовершеннолетние. Те, на чье решение могут повлиять вышестоящие в иерархии лица. Нет запрета на участие таких групп в исследованиях, участвовать можно. Но норма говорит, что исследование с участием таких лиц допускается только в том случае, если невозможно привлечение других категорий и если известно, что участие в исследовании принесет конкретно этим участникам пользу.
Государство постановлением правительства позволило регистрировать препараты без необходимого объема клинических данных. Но вопрос о том, насколько нужно рискнуть и выпустить на рынок не до конца исследованный препарат — за экспертами. Мы видим, что во всем мире требования все равно соблюдаются: третья фаза обязательно проводится. С другой стороны, мы понимаем, что оценивать должны эксперты, а на экспертов сейчас явно оказывается давление. У нас ФГБУ оценивает и принимает решение о регистрации. Вы сидите в ФГБУ, а тут выходит замминистра и говорит: у нас вакцина будет зарегистрирована. Мы же все понимаем сигналы, которые посылают нам сверху, нас учили этому долгие годы, мы уже к этому привыкли.
Когда автомобиль выпускают с конвейера, есть набор необходимых тестов: нужно тормозную систему проверить, краш-тест пройти и так далее. А здесь, по сути, речь идет о препарате, который планируют применять массово. Причем автомобиль еще можно каким-то образом проверить визуально — ну, гайки закручены, а здесь что-то попадает внутрь. И более того, мы не знаем, какой от этого будет эффект.
Кто выступил инициатором обращения в Минздрав? Основной инициатор — я. Мы по роду деятельности уже с самого начала пандемии отслеживаем, что происходит на нашем фронте. Здесь можно попытаться сказать, что мы хотим кинуть тень на институт Гамалеи. Но это не так. Неважно, кто является оппонентом, если речь идет о нарушении правил игры, по которым должна проводиться разработка. Мы не будем стесняться в отношении ни одной компании.
Это обращение непосредственно с представителями компании AstraZeneca (разработчик другой вакцины от COVID-19, — Forbes) не согласовывалось. Открытые письма, обращения согласовываются на уровне правления. Представители компании AstraZeneca не входят в правление АОКИ. Я думаю, что они узнали о нем из публикаций.
Нас можно обвинить в чем угодно. Можно сказать, что мы иностранные агенты. Можно сказать, что мы выступаем в интересах конкретно взятого конкурента. Но я как Светлана Завидова заявляю, что это не так.
Тот вопрос, который мы задали, может быть на руку конкурентам. Может быть так истолкован. Но совершенно точно в основе нашей активности не лежит конкурентная борьба. Более того, смешно даже называть вакцину, разработанную Центром Гамалеи, конкурентом той же оксфордской вакцины. Это все равно что сравнивать игрушечную машинку в песочнице и Bentley. 42 000 добровольцев в третьей фазе и 76, которые Центр Гамалеи набрал по исследованию. Это просто несоизмеримо.
Эффективна ли вакцина Центра имени Гамалеи? Я не являюсь экспертом для того, чтобы оценивать вакцины. Как человек, который работает на этом рынке, я слышу комментарии отдельно взятых экспертов, которые вряд ли отважатся заявлять их в открытую.
Характеристики любого препарата складываются из трех составляющих: безопасность, эффективность и качество. Человечество пока не придумало никакой другой схемы, как выпускать на рынок препарат, изучив сначала его в доклинических исследованиях, потом последовательно в исследованиях первой клинической фазы, второй и третьей. Причем в первой проверяется безопасность. Потом уже подбирается дозировка, изучается эффективность. И только третья фаза позволяет набрать данные о том, как препарат влияет на конкретные заболевания. Что сделали у нас? Объединили первую и вторую фазы, отчет по ней не опубликовали, и уже говорится о массовой вакцинации. Мы понимаем, что ни о каких доказательствах с точки зрения клинической медицины говорить невозможно.
Мы можем, конечно, рассматривать вопрос с точки зрения конкуренции. Но это вопрос другой плоскости. Наше желание получить быстрее некий продукт — это, конечно, замечательно. Но вот хороший анекдот: невозможно, собрав 9 беременных женщин в одной комнате, заставить их родить за один месяц. Все равно должен пройти тот срок, который необходим, чтобы проверить препарат.
За рубежом ускорение (при разработке препаратов во время пандемии. — Forbes) состоит исключительно в кооперации по обмену информацией. Но нет ни одной страны, которая бы не провела третьей фазы. Ни одна из конкурентных вакцин, которые сейчас разрабатываются в разных странах, не регистрируется без третьей фазы. И Оксфорд, и Moderna, и китайцы. Более того, в Китае даже публикации выходят, говорят: «Ну русские вообще самые отважные, решили вот». Это действительно серьезнейшее нарушение всей системы разработки препарата. Это не шутки. Ни один конкурент на такое не идет.
Как идут исследования других вакцин? Имеются ли нарушения? Государственный центр «Вектор» получил разрешение 24 июля на первую и вторую фазу исследований. Пока я не слышала, чтобы они заявляли о регистрации 12 августа или 12 сентября.
В Кировском государственном медицинском университете проходит тестирование полиомиелитной вакцины «БиВак полио» в качестве средства профилактики заболевания COVID-19. Ее начали давать добровольцам, назвав это наблюдательным исследованием. Что, по сути, тоже нарушение правил, потому что это никакое не наблюдательное, это чистое интервенционное исследование, поскольку препарат применяется вне показаний. Мы направили запрос в Минздрав о том, знают ли они что-нибудь об этом исследовании.
Какова реакция чиновников Минздрава на критику? В целом, наверное, общение любого органа государственной власти с бизнесом - это диалог удава с кроликом. Поэтому ответа мы не ожидаем. Некой реакции, возможно, да. Даже сегодня (разговор происходил 10 августа. — Forbes) на радиостанции «Москва FM» вывели в эфир одновременно меня и представителя Гамалеи. И они начали заявлять, что они, на самом деле, не имели в виду массовую вакцинацию, они имели в виду, что регистрация — это разрешение на третью фазу. Они уже начинают искать выход из сложившейся ситуации, пытаясь пояснить свою позицию, но совершенно нагло жонглируют понятиями. Потому что разрешение на исследование — это разрешение на исследование. Это как бы лошадь, а регистрация — это телега. Регистрация — это уже разрешение на фактическое использование. И подменять одно другим, в общем, не очень красиво.
